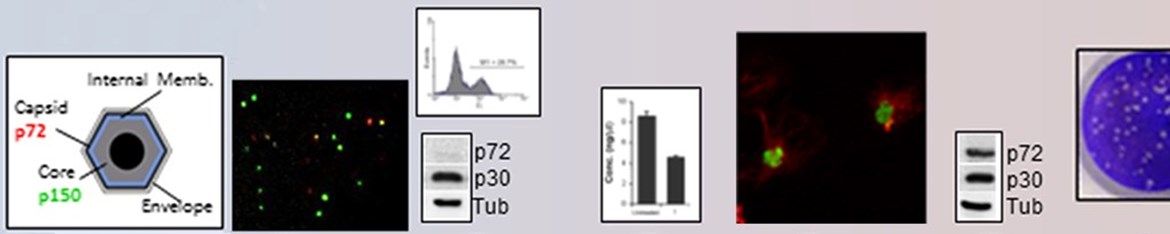
El Virus de la Peste porcina africana (VPPA) es el agente causal de una de las enfermedades infecciosas más importantes del cerdo doméstico, que afecta en la actualidad de forma endémica a países del África subsahariana, Cerdeña y más recientemente a Rusia y otras repúblicas Caucásicas. Desde allí ha producido brotes esporádicos en las tres repúblicas Bálticas y Polonia y hoy en día es una seria amenaza para los países de la Unión Europea, con posibilidades de extensión a otros continentes. No existe una vacuna comercial y aún se desconocen numerosos aspectos relevantes de la biología del virus y de su interacción con la célula hospedadora. En proyectos previos hemos caracterizado cómo la entrada del virus en la célula se realiza mediante endocitosis dependiente de dinamina y clatrina, requiere colesterol y también señalización de actina. Pudimos observar además que una vez que el virus atraviesa la membrana, ingresa en la vía endocítica y se localiza precozmente en el endosoma temprano. Desde allí continúa su proceso de maduración hasta el endosoma tardío donde ocurre la decapsidación de la partícula vírica como factor desencadenante y esencial para la liberación del genoma del virus y el comienzo de la replicación. En el presente proyecto nos proponemos estudiar los factores celulares y víricos necesarios para las siguientes fases del ciclo posteriores a la decapsidación, tales como la penetración de los viriones desde el endosoma al citoplasma, la fusión de membranas y el establecimiento de la factoría vírica para el comienzo de la replicación. Se estudiarán las dianas moleculares para la inmunidad innata en estas fases de la infección. También, el remodelado de los lípidos intracelulares, el papel del flujo de colesterol del endosoma al citoplasma y de las proteínas que intervienen en la movilización de colesterol desde el endosoma. Investigaremos la relevancia de la interacción de la ubiquitin conjugasa del VPPA con proteinas celulares y del sistema ubiquitina-proteasoma en la liberación del genoma al citoplasma en el lugar adecuado para el comienzo de la replicación. Se realizará un análisis del soporte físico y bioquímico de las factorías virales considerando distintos orígenes para las membranas que soportan la replicación. Basados en la identificación de estos factores se generarán virus mutantes de deleción incapaces de infectar eficientemente por su función en las fases tempranas de la infección, y que podrían constituir futuros candidatos vacunales.
- Borca M.V., V. O’Donnell, L.G. Holinka, D.K. Rai, B. Stanford, M. Alfano, J. Carlson, P.A. Azzinaro, C. Alonso, D.P. Gladue. 2016. Identification of a BAT3 as an essential host factor for African Swine Fever Virus protein EP152R. Virus Research Sept;223:181-189. DOI: 10.1016/j.virusres.2016.07.013
- Muñoz-Moreno R., M.A. Cuesta-Geijo, C. Martínez-Romero, L. Barrado-Gil, I. Galindo, A. García-Sastre and C. Alonso. 2016. Antiviral role of Interferon-induced Transmembrane proteins in African swine fever virus infection PLoS ONE11(4): e0154366. CLAVE: A. DOI:10.1371/journal.pone.0154366 Klionsky D.J.,...C. Alonso…et al. 2016. Guidelines for the Use and Interpretation of Assays for Monitoring Autophagy, 2nd Edition. Autophagy 12 (1), 1-222, 2016. IF 11,753. DOI: 10.1080/15548627.2015. 1100356
- Cuesta-Geijo M.A., M. Chiappi, I. Galindo, L. Barrado-Gil, R. Muñoz-Moreno, José L. Carrascosa and C. Alonso. 2016. Cholesterol flux is required for endosomal progression of African swine fever virus. Journal of Virology 90 (3): 1534-43. doi: 10.1128/JVI.02694-15. CLAVE:A IF: 4.439 PMID: 26608317
- Metz, G.E., I. Galindo, M.M. Abeyá, M.G. Echeverría and C. Alonso. 2016. Intrinsic, Extrinsic and Endoplasmic Reticulum stress-induced apoptosis in RK13 cells infected with Equine Arteritis Virus. Virus Research 213: 219-223. DOI: 10.1016/j.virusres.2015.12.010. CLAVE:R IF: 2.941 PMID: 26732484
- Muñoz-Moreno R., I. Galindo, M.A. Cuesta-Geijo, L. Barrado-Gil and C. Alonso. 2015. Host cell targets for African swine fever virus. Special issue Cell Response to Viral Infection. Virus Research, 209: 118-127. doi:10.1016/j.virusres.2015.05.026 CLAVE:R IF: 2.941 PMID: 26057710
- Muñoz-Moreno R., L. Barrado-Gil, I. Galindo and C. Alonso. 2015. Analysis of HDAC6 and BAG3-aggresome pathways in African swine fever viral factory formation. Viruses 7, 1823-1831 doi: 10.3390/v7041823 CLAVE:A IF: 3.279 PMID: 25856634
- Galindo I., M.A. Cuesta-Geijo, K. Hlavova, R. Muñoz-Moreno, Lucía Barrado-Gil, Javier Dominguez and C. Alonso. 2015. African swine fever virus infects macrophages, the natural host cells, via clathrin- and cholesterol-dependent endocytosis. Virus Research, 200: 45-55. doi: 10.1016/j.virusres.2015.01.022. CLAVE:A IF: 2.941 PMID: 25662020
Tags
- peste porcina
- virus